QMC1-EngTel (Plano de Ensino): mudanças entre as edições
Ir para navegação
Ir para pesquisar
Criou página com '{{Cab1-IF-SC-Engtelecom}} <BIG><center> '''Plano de Ensino de 2012-2''' </center></BIG> ;Dados gerais {{SUC | right|thumb|200px|CADEIA DE SUCESSORES}} :COMPO...' |
Sem resumo de edição |
||
| (20 revisões intermediárias por 3 usuários não estão sendo mostradas) | |||
| Linha 1: | Linha 1: | ||
{{Cab1-IF-SC-Engtelecom}} | {{Cab1-IF-SC-Engtelecom}} | ||
<BIG><center> | <BIG><center> | ||
'''Plano de Ensino de 2012-2''' | '''Plano de Ensino de 2012-2 - atual''' | ||
</center></BIG> | </center></BIG> | ||
;Dados gerais | ;Dados gerais | ||
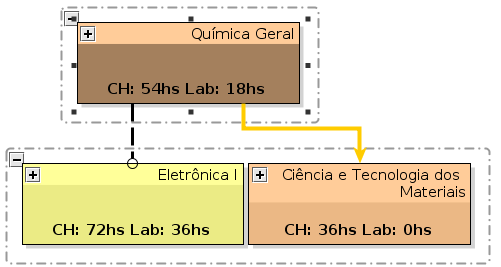
:COMPONENTE CURRICULAR: '''[[QMC1-EngTel|QMC1]]''' - QUÍMICA GERAL | |||
:COMPONENTE CURRICULAR: '''[[ | :<SMALL>CARGA HORÁRIA: 3 HORAS/SEMANA 54 HORAS. TEÓRICA = 36 HORAS. LABORATÓRIO = 18 HORAS</SMALL><BR> | ||
:<SMALL>CARGA HORÁRIA: | {{SUC | QMC1.png | 2}} | ||
:<SMALL>CÓDIGO: '''QMC29002''' </SMALL><BR> | |||
:<SMALL>PRÉ REQUISITOS: </SMALL><BR> | :<SMALL>PRÉ REQUISITOS: </SMALL><BR> | ||
:<SMALL>DISCIPLINAS SUCESSORAS: [[QMC2-EngTel|QMC2]], [[ELA1-EngTel|ELA1*]] </SMALL><BR> | |||
:<SMALL> MÓDULO BÁSICO </SMALL><BR> | :<SMALL> MÓDULO BÁSICO </SMALL><BR> | ||
;Objetivos | ;Objetivos | ||
:1. Compreender o processo evolutivo das teorias atômicas; | |||
:2. Conhecer e aplicar Tabela Periódica com base nas características periódicas sob a qual, a mesma foi construída. | |||
:3. Compreender as reações de óxidoredução e suas principais funções no cotidiano e na indústria de Telecomunicações. | |||
:4. Preparar e conhecer soluções de diferentes características químicas; | |||
;Ementa | ;Ementa | ||
: | :Conceitos fundamentais da química. Estrutura da matéria. Periodicidade química: propriedades atômicas e tendências periódicas. Ligações químicas: ligação iônica, covalente, ligação metálica, forças inter e intramoleculares. Reações químicas. Introdução à química dos polímeros. Introdução à química do meio ambiente. | ||
;Conteúdo Programático | ;Conteúdo Programático | ||
:1. | :1.Átomos, moléculas e íons (2h). | ||
:2.Estrutura eletrônica dos átomos (10h). | |||
:3. Conceitos básicos de ligações química (2h). | |||
:4. Forças intermoleculares, líquidos e sólidos (2h). | |||
:5. Reações em soluções aquosas (2h). | |||
:6. Reações de Oxirredução (Eletroquímica) (8h). | |||
:7. Química Ambiental: Atmosfera, química da troposfera (4h). | |||
:8. Avaliações (4h). | |||
:9. Aulas Experimentais (18h). | |||
; | ;Estratégias de ensino utilizadas | ||
:Aulas expositivas e dialogadas com o uso de lousa, giz, projetor multimídia, resolução de exercícios e aulas de laboratório. | |||
;Critérios e instrumentos de avaliação | |||
:Para compor o conceito final serão consideradas as seguintes modalidades de avaliações: | |||
:- avaliações individuais, com ou sem consulta ao material didático, que poderão possuir questões discursivas e/ou objetivas; (no mínimo duas :avaliações: P1 + P2) | |||
:- Avaliações das aulas práticas, que poderão ser na forma de relatórios (Relatórios das aulas experimentais), avaliações práticas ou questões :em avaliações escritas.; | |||
:Os relatórios não serão aceitos fora do prazo e não haverá recuperação paralela para os mesmos. | |||
:A recuperação dos conteúdos deverá ser paralela, no decorrer do semestre e com a avaliação no final do mesmo. | |||
:O processo avaliativo visa auxiliar o professor a adotar metodologias e estratégias de ensino para que os alunos alcancem um conceito igual ou :superior a “C” nos conteúdos trabalhados durante o semestre. | |||
:O conceito final será: A, B, C ou D (INAPTO). | |||
:O cronograma de avaliações e atividades poderá ser alterado, tanto quanto o número de atividades escritas, conforme necessidade eventual dos :acadêmicos ou do professor. | |||
:Em caso de ausência do acadêmico nas datas previstas para as avaliações individuais e apresentação de atividades, este deverá solicitar, via :requerimento justificado, nova data de oportunidade de realização da avaliação escrita, junto a coordenação pedagógica. | |||
; | ;Atividades Complementares | ||
:Aulas experimentais no laboratório de química (18h) | |||
;Bibliografia Básica | ;Bibliografia Básica | ||
: | # RUSSELL, John Blair '''Química geral'''; 2ª ed. São Paulo:Pearson Makron Books, 2008. 662p. ISBN 8534601925 | ||
# MAIA, Daltamir Justino; BIANCHI, J. C. de A. '''Química geral: fundamentos'''; 1ª ed. São Paulo:Pearson Prentice Hall, 2009. 436p. ISBN 9788576050513 | |||
# BROWN, Theodore L.; LEMAY JR., H. Eugene; BURSTEN, Bruce E.; BURDGE, Julia R. '''Química: a ciência central'''; 9ª ed. São Paulo:Pearson Prentice Hall, 2010. 972p. ISBN 9788587918420 | |||
;Bibliografia Complementar | ;Bibliografia Complementar | ||
: | # FONSECA, Martha Reis Marques da '''Química: química geral'''; 1ª ed. São Paulo:FTD, 1992. 412p. ISBN 8532206506 | ||
# RUSSELL, John Blair '''Química geral'''; 2ª ed. São Paulo:Pearson Makron Books, 2008. 628p. ISBN 8534601518 | |||
# USBERCO, João; SALVADOR, Edgard '''Química 1 - Química Geral - Ensino Médio'''; 14ª ed. São Paulo:Saraiva, 2009. 560p. ISBN 9788502084759 | |||
# KOTZ, John C.; TREICHEL JUNIOR, Paul; WEAVER, Gabriela C. '''Química geral e reações químicas'''; 6ª ed. São Paulo:Cengage Learning, 2010. 708p. ISBN 9788522106912 | |||
: | |||
; | =ANEXOS= | ||
;[[Cronograma de atividades (QMC1-EngTel) | Cronograma de atividades]] | |||
;[http://tele.sj.ifsc.edu.br/arquivos/publicos/Horario/ Horário de Aula e Atendimento Paralelo] | |||
{{ENGTELECO}} | {{ENGTELECO}} | ||
Edição atual tal como às 18h10min de 28 de fevereiro de 2019

|
MINISTÉRIO DA EDUCAÇÃO |
Plano de Ensino de 2012-2 - atual
- Dados gerais
- COMPONENTE CURRICULAR: QMC1 - QUÍMICA GERAL
- CARGA HORÁRIA: 3 HORAS/SEMANA 54 HORAS. TEÓRICA = 36 HORAS. LABORATÓRIO = 18 HORAS
- Objetivos
- 1. Compreender o processo evolutivo das teorias atômicas;
- 2. Conhecer e aplicar Tabela Periódica com base nas características periódicas sob a qual, a mesma foi construída.
- 3. Compreender as reações de óxidoredução e suas principais funções no cotidiano e na indústria de Telecomunicações.
- 4. Preparar e conhecer soluções de diferentes características químicas;
- Ementa
- Conceitos fundamentais da química. Estrutura da matéria. Periodicidade química: propriedades atômicas e tendências periódicas. Ligações químicas: ligação iônica, covalente, ligação metálica, forças inter e intramoleculares. Reações químicas. Introdução à química dos polímeros. Introdução à química do meio ambiente.
- Conteúdo Programático
- 1.Átomos, moléculas e íons (2h).
- 2.Estrutura eletrônica dos átomos (10h).
- 3. Conceitos básicos de ligações química (2h).
- 4. Forças intermoleculares, líquidos e sólidos (2h).
- 5. Reações em soluções aquosas (2h).
- 6. Reações de Oxirredução (Eletroquímica) (8h).
- 7. Química Ambiental: Atmosfera, química da troposfera (4h).
- 8. Avaliações (4h).
- 9. Aulas Experimentais (18h).
- Estratégias de ensino utilizadas
- Aulas expositivas e dialogadas com o uso de lousa, giz, projetor multimídia, resolução de exercícios e aulas de laboratório.
- Critérios e instrumentos de avaliação
- Para compor o conceito final serão consideradas as seguintes modalidades de avaliações:
- - avaliações individuais, com ou sem consulta ao material didático, que poderão possuir questões discursivas e/ou objetivas; (no mínimo duas :avaliações: P1 + P2)
- - Avaliações das aulas práticas, que poderão ser na forma de relatórios (Relatórios das aulas experimentais), avaliações práticas ou questões :em avaliações escritas.;
- Os relatórios não serão aceitos fora do prazo e não haverá recuperação paralela para os mesmos.
- A recuperação dos conteúdos deverá ser paralela, no decorrer do semestre e com a avaliação no final do mesmo.
- O processo avaliativo visa auxiliar o professor a adotar metodologias e estratégias de ensino para que os alunos alcancem um conceito igual ou :superior a “C” nos conteúdos trabalhados durante o semestre.
- O conceito final será: A, B, C ou D (INAPTO).
- O cronograma de avaliações e atividades poderá ser alterado, tanto quanto o número de atividades escritas, conforme necessidade eventual dos :acadêmicos ou do professor.
- Em caso de ausência do acadêmico nas datas previstas para as avaliações individuais e apresentação de atividades, este deverá solicitar, via :requerimento justificado, nova data de oportunidade de realização da avaliação escrita, junto a coordenação pedagógica.
- Atividades Complementares
- Aulas experimentais no laboratório de química (18h)
- Bibliografia Básica
- RUSSELL, John Blair Química geral; 2ª ed. São Paulo:Pearson Makron Books, 2008. 662p. ISBN 8534601925
- MAIA, Daltamir Justino; BIANCHI, J. C. de A. Química geral: fundamentos; 1ª ed. São Paulo:Pearson Prentice Hall, 2009. 436p. ISBN 9788576050513
- BROWN, Theodore L.; LEMAY JR., H. Eugene; BURSTEN, Bruce E.; BURDGE, Julia R. Química: a ciência central; 9ª ed. São Paulo:Pearson Prentice Hall, 2010. 972p. ISBN 9788587918420
- Bibliografia Complementar
- FONSECA, Martha Reis Marques da Química: química geral; 1ª ed. São Paulo:FTD, 1992. 412p. ISBN 8532206506
- RUSSELL, John Blair Química geral; 2ª ed. São Paulo:Pearson Makron Books, 2008. 628p. ISBN 8534601518
- USBERCO, João; SALVADOR, Edgard Química 1 - Química Geral - Ensino Médio; 14ª ed. São Paulo:Saraiva, 2009. 560p. ISBN 9788502084759
- KOTZ, John C.; TREICHEL JUNIOR, Paul; WEAVER, Gabriela C. Química geral e reações químicas; 6ª ed. São Paulo:Cengage Learning, 2010. 708p. ISBN 9788522106912
1 ANEXOS