QMC1-EngTel (Plano de Ensino)
Ir para navegação
Ir para pesquisar

|
MINISTÉRIO DA EDUCAÇÃO |
Plano de Ensino de 2013-1
- Dados gerais
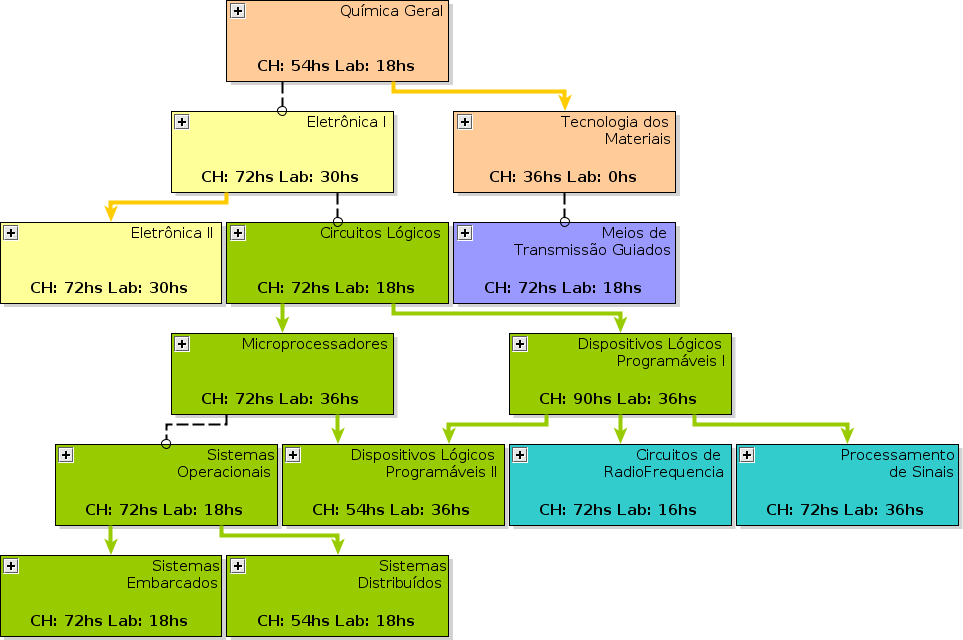
[[Arquivo:
|right | thumb |
250px | UCs vizinhas]]
- COMPONENTE CURRICULAR: QMC1 - QUÍMICA GERAL
- CARGA HORÁRIA: 3 HORAS/SEMANA 54 HORAS. TEÓRICA = 36 HORAS. LABORATÓRIO = 18 HORAS
- PRÉ REQUISITOS:
- DISCIPLINAS SUCESSORAS: QMC2, ELA1*
- MÓDULO BÁSICO
- Objetivos
- 1. Compreender o processo evolutivo das teorias atômicas;
- 2. Conhecer e aplicar Tabela Periódica com base nas características periódicas sob a qual, a mesma foi construída.
- 3. Compreender as reações de óxidoredução e suas principais funções no cotidiano e na indústria de Telecomunicações.
- 4. Preparar e conhecer soluções de diferentes características químicas;
- Ementa
- Conceitos fundamentais da química. Estrutura da matéria. Periodicidade química: propriedades atômicas e tendências periódicas. Ligações químicas: ligação iônica, covalente, ligação metálica, forças inter e intramoleculares. Reações químicas. Introdução à química dos polímeros. Introdução à química do meio ambiente.
- Conteúdo Programático
- 1.Átomos, moléculas e íons (6h).
2.Estrutura eletrônica dos átomos (6h).
3. Conceitos básicos de ligações química (6h).
4. Forças intermoleculares, líquidos e sólidos (6h).
5. Materiais modernos (6h).
6. Reações em soluções aquosas (6h).
7. Química Ambiental: Atmosfera, quimica da troposfera (6h).
8. Avaliações (6h).
- Cronograma de atividades
| Aula | Data | Horas | Conteúdo | Recursos | |
|---|---|---|---|---|---|
| 1 | 4/4 | 2 | Aula inaugural: apresentação do curso. Entrega do programa de aprendizagem, Acordo pedagógico. | Projetor Multimídia/Quadro Giz | |
| 2 | 5/4 | 2 | Introdução: matérias e medidas. | Projetor Multimídia/Quadro Giz | |
| 3 | 11/4 | 2 | Átomos, moléculas e íons Exercícios p. 60 | Projetor Multimídia/Quadro Giz | |
| 4 | 18/4 | 2 | Reações em soluções aquosas e estequiometria de soluções. | Projetor Multimídia/Quadro Giz | |
| 5 | 19/4 | 2 | Laboratório: Normas de Segurança | Lab. de Química | |
| 6 | 25/4 | 2 | Estrutura Eletrônica dos átomos. | Projetor Multimídia/Quadro Giz | |
| 7 | 2/5 | 2 | Propriedades Periódicas dos átomos | Projetor Multimídia/Quadro Giz | |
| 8 | 3/5 | 2 | Aula Laboratório: Vidrarias (Materiais do Laboratório), utilização das Balanças e determinação da densidade. | Lab. de Química | |
| 9 | 9/5 | 2 | Conceitos Básicos de Ligações Químicas | Projetor Multimídia/Quadro Giz | |
| 10 | 11/5 | 2 | Aula Laboratório: Preparo de Soluções em g/L e mol/L | Lab. de Química | |
| 11 | 16/5 | 2 | Forças Intermoleculares, líquidos e Sólidos | Projetor Multimídia/Quadro Giz | |
| 12 | 17/5 | 2 | Aula Laboratório: Reações Químicas. | Lab. de Química | |
| 13 | 23/5 | 2 | Revisão para avaliação e resolução de Exercícios. | Quadro e Giz | |
| 14 | 30/5 | 2 | Recesso Escolar | ||
| 15 | 31/5 | 2 | Recesso Escolar (Aula Laboratório) | ||
| 16 | 6/6 | 2 | Avaliação Individual Escrita 1 | ||
| 17 | 13/6 | 2 | Reações de oxirredução: Nox e balanceamento de equações de oxirredução. | Projetor Multimídia/Quadro Giz | |
| 18 | 14/6 | 2 | Aula Laboratório: teste da chama. | Lab. de Química | |
| 19 | 20/6 | 2 | Células voltáicas e espontaniedade de reações redox. | Projetor Multimídia | |
| 20 | 22/6 | 2 | Aula Laboratório: oxidação e redução. | Lab. de Química | |
| 21 | 27/6 | 2 | Corrosão e eletrólise. | Projetor Multimídia/Quadro Giz | |
| 22 | 28/6 | 2 | Aula Laboratório: Eletroquímica e a pilha de Daniel. | Lab. de Química | |
| 23 | 4/7 | 2 | Metais e metalurgia | Projetor Multimídia/Quadro Giz | |
| 24 | 11/7 | 2 | Introdução a química dos polímeros. | Projetor Multimídia/Quadro Giz | |
| 25 | 12/7 | 2 | Aula Laboratório: Estudo Quantitativo da Reação de um Metal com Ácido | Lab. de Química | |
| 26 | 18/7 | 2 | Química Ambiental | Projetor Multimídia/Quadro Giz | |
| 27 | 25/7 | 2 | Avaliação Individual Escrita 2 | ||
| 28 | 26/7 | 2 | Aula de Laboratório: Determinação simples de oxigênio Dissolvido em água. | Lab. de Química | |
| 29 | 1/8 | 2 | Considerações Finais | Projetor Multimídia/Quadro Giz | |
| TOTAL | 58 | ||||
- Estratégias de ensino utilizadas
- Aulas expositivas e dialogadas com o uso de lousa, giz, projetor multimídia, resolução de exercícios e aulas de laboratório.
- Critérios e instrumentos de avaliação
- Para compor o conceito final serão consideradas as seguintes modalidades de avaliações:
- - avaliações individuais, com ou sem consulta ao material didático, que poderão possuir questões discursivas e/ou objetivas;
- - Avaliações das aulas práticas, que poderão ser na forma de relatórios, avaliações práticas ou questões em avaliações escritas.;
- - Relatórios das aulas experimentais;
- - Relatórios das visitas técnicas.
- Os relatórios não serão aceitos fora do prazo e não haverá recuperação paralela para os mesmos.
- A recuperação dos conteúdos deverá ser paralela, no decorrer do semestre e com a avaliação do semestre junto com a avaliação subsequente.
- O processo avaliativo visa auxiliar o professor a adotar metodologias e estratégias de ensino para que os alunos alcancem um conceito igual ou :superior a “C” nos conteúdos trabalhados durante o semestre.
- O conceito final será: A, B, C ou D (INAPTO).
- O cronograma de avaliações e atividades poderá ser alterado, tanto quanto o número de atividades escritas, conforme necessidade eventual dos :acadêmicos ou do professor.
- Em caso de ausência do acadêmico nas datas previstas para as avaliações individuais e apresentação de atividades, este deverá solicitar, via :requerimento justificado, nova data de oportunidade de realização da avaliação escrita, junto a coordenação pedagógica.
- Em caso de informações ou orientações eventuais o acadêmico será comunicado em sala.
- Atividades Complementares
- Prever laboratórios (18h)
- Bibliografia Básica
- 1.BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Pearson Prentice Hall, 2010. 972 p. ISBN 978-8587915420.
- Bibliografia Complementar
- Professores Responsáveis
- Prof. Éder da Silva e Sá